Свойства и состав
Чтобы получить этот камень, нужно, как минимум, два элемента. Во-первых, это углерод. Его наличие обязательно. А дальше уже есть выбор: металл, или неметалл. Главное, чтобы выполнялось правило: электроотрицательность (сила, с которой атомы элемента притягивают к себе чужие электроны) обязательного компонента выше, чем его «партнера». Иначе получатся совсем другие соединения.
Впервые об этом соединении заговорили в Англии еще в 19-м веке. Однако, слава первооткрывателя досталась французу, благодаря опытам которого вещество официально признали, случилось это лишь к концу столетия. А теперь от том, какие качества присущи этому соединению:
- Материал необычайно твердый. По этому показателю он почти догнал алмаз. Среди рекордсменов – карбид вольфрама (9 из 10 возможных баллов). Это открывает сотни путей его применения.
- Чтобы расплавить камень, нужно будет приложить немало усилий. Ведь для этого необходимо нагреть его до 2-х, или даже 3-х тысяч градусов Цельсия. Эта цифра будет выше значений, необходимых для того, чтобы изменить состояние металлических веществ, до того, как они оказались в составе карбида.
- Это очень «не контактное» соединение. Так, реакция карбида на очень многие вещества будет нулевой. Для этого нужны особые условия. Потому кислоты, и прочие вещества, способствующие коррозии, им не страшны.
- Но предыдущий пункт не касается воды. Как Вы уже поняли из рассказа выше, карбид и вода – часто идут рука об руку. В случае, к примеру, когда задействован карбид кальция, для этого подойдет абсолютно любая влага, не нужно никаких условностей. Если же в работе карбид кремния, то без нагрева никак – нужен раскаленный пар (1800 градусов).
Науке известны три разновидности таких соединений:
Что их отличает, так это очень прочные связи между атомами. Когда упоминается такой тип, то речь лишь о двух элементах, соседствующих с углеродом: первый – это бром, второй – кремний. Все вышеперечисленные свойства в этих соединениях «выставлены» на максимум. Это и небывалая твердость, и стойкость. Захотите растворить – не получится без участия едких кислот огромной концентрации. Тоже самое касается и взаимодействия с кислородом. Просто так не получится, нужен нагрев, и не хилый – до 1000 градусов.
Солеобразные, либо ионные
Здесь в контакт с углеродом вступает либо алюминий, или металл, но не абы какой, а только из 1-2 групп хим. таблицы. Придать такому соединению жидкую форму все еще не очень просто, нужен предельный нагрев. А вот кислота незамеченной не останется, в результате такой «встречи» карбид распадется.
Получаются они из металлов, относящихся к 4-8 группе, сюда же идут кобальт, а также никель, ну и, конечно, железо. Если рассматривать их химическое строение, увидим, что атомы углерода буквально разбросаны, между ними нет связей, они словно вкрапления в образовавшихся в металле пробелах. Потому то они весьма тугоплавкие, можно даже сказать, чемпионы в этом деле. Это позволяет применять их при изготовлении сверл (победитовые сверла).
Производство – карбид – кальций
Производство карбида кальция состоит из следующих стадий: обжига известняка, приготовления шихты, получения карбидного плава, дробления или гранулирования карбида кальция.
Производство карбида кальция термической реакцией между коксом и окисью кальция имеет широкое распространение. Так, в 1965 г. для этих целей потреблялось более 2 500 000 т кокса во всем мире, из которых, вероятно, от 800 до 900 тыс. т в странах Западной Европы. Но не следует ожидать развития производства карбида кальция в ближайшие годы. Во многих случаях ацетилен может быть заменен этиленом, который более экономичен. Кроме того, для производства ацетилена с карбидным процессом конкурируют другие процессы, принцип которых – пиролиз таких углеводородов, как метан, этан и легкие бензины. Этот пиролиз может происходить при внешнем обогреве, частичном сгорании или под действием электрического тока в форме дуги или разряда. Эти процессы обычно дают смеси ацетилена и этилена, пригодные для использования. Нельзя сказать, что эти процессы были хорошо отработаны и надежны к 1967 г., но можно надеяться, что многие из них позволят получать ацетилен с ценой менее 0 80 франков / кг; в связи с этим будет ограничена замена его на этилен.
Производство карбида кальция необходимо вести на однородном сырье. Поэтому карбидные заводы работают обычно на сырье, получаемом с определенных, достаточно изученных месторождений.
Производство карбида кальция и производство извести характерны высокими температурами процессов и выделением большого количества пыли; само производство карбида кальция относится к числу взрывоопасных и огнеопасных.
Производство карбида кальция относится к числу электротермических производств.
Производство карбида кальция по различным причинам является первым основным процессом химической технологии, с которого обычно начинается процесс индустриального развития в слаборазвитых странах. Объем промышленного производства карбида кальция продолжает увеличиваться в высокоразвитых промышленных странах, в то же время продолжает расширяться мировое производство.
Производство карбида кальция относится к числу электротермических производств.
| Схема производства карбида кальция. / – электрическая печь. 2 – бункера. 3-транспортер. 4 – трубы-питатели. 5 – летка. 6 – вращающийся барабан. 7 – элеватор. S – хранилище. |
Производство карбида кальция осуществляется в непрерывно действующих электрических печах прямого нагрева ( см. гл. VII) двух типов – однофазных и трехфазных. Мощные карбидные печи обычно трехфазные, с прямоугольной или элиптической ванной, в которой в ряд располагаются самообжигающиеся электроды. Мощность современных карбидных печей достигает 30 – 40 тыс. кет.
Производство карбида кальция во всех странах в последнее время превышает 3 5 млн. тв год ( общий расход электроэнергии составил около Ю млрд. квт-ч), электротермическое производство фосфора ( по неполным данным) составляет около 500 тыс. от в год ( общий расход электроэнергии свыше.
| Схемы непрерывного наращивания электродов. |
Производство карбида кальция осуществляется в непрерывно действующих электрических печах прямого нагрева.
Производство карбида кальция в России началось в 1908 г. В Земко-вицах были сооружены две небольшие однофазные печи по 500 кВ – А.
Поскольку производство карбида кальция освоено сравнительно давно, дальнейшее снижение расходных показателей протекает относительно медленно.
Однако производство карбида кальция, несмотря на постоянное совершенствование технологического процесса, остается громоздким и тяжелым по условиям труда. Многие крупные месторождения известняка, пригодного для переработки, не могут использоваться, так как перевозка известняка на дальние расстояния невыгодна.
Техника безопасности
Карбид для сварки относится к классу взрывоопасных веществ. Безопасное применение карбида обеспечивается учетом ряда условий:
- Ацетилен является легковоспламеняющимся газом, а сам сухой карбид также взрывоопасен, поэтому возле места проведения работ не должно быть источников открытого огня, даже таких незначительных, как зажигалки и зажженные сигареты.
- Запрещено использование карбида в гранулах до 2 мм или карбидной пыли, так как она растворяется очень быстро, что приводит к выделению большого количества газа. Из-за этого в генераторе образуется сверхвысокое давление и может произойти взрыв.
- Запрещена работа болгаркой или электросварочным аппаратом вблизи газосварочных работ и мест установки карбидных барабанов.
- Вещество должно храниться в сухом и герметичном месте, в котором нет водопроводов, канализационных труб и, тем более, газового оборудования.
- Карбидная пыль при попадании вызывает раздражение кожи, глаз, слизистых оболочек. Работа с этим веществом должна проходить с применением средств индивидуальной защиты – очков, перчаток и респиратора.
- При попадании карбида на кожу или в глаза его необходимо промыть большим количеством теплой воды, а затем аккуратно удалить остатки карбида пинцетом или влажным тампоном.
- При работе с карбидом в мастерской все сварочное оборудование должно быть размещено в отдельных частях помещения, система вентиляции помещения должна обеспечивать отвод горючих газов, а помещение должно быть освобождено от горючих материалов.

- Ацетиленовые генераторы запрещено устанавливать в подвальных помещениях и жилых зданиях.
- Перед запуском генератор следует осмотреть на предмет отсутствия видимых трещин и вмятин корпуса.
- Во время проведения работ генератор должен оставаться в вертикальном положении, манометр должен быть исправен и хорошо виден сварщику или его помощнику.
- По окончании работы оставшийся в генераторе раствор карбида должен быть выработан целиком, а образовавшаяся известь утилизирована.
- Повторное использование мокрых кусков карбида не допускается;
- Запрещено вскрывать генератор под давлением (во время продолжающейся реакции).
- Баллоны для ацетилена хранятся и перевозятся со специальными предохранительными колпаками на клапанах.
Если имеется необходимость в регулярном использовании оборудования для газовой сварки и резки, лучше купить профессиональное оборудование, изготовленное на промышленном предприятии. Применение самодельных генераторов чревато получением тяжелых травм и угрозой для жизни.
Карбидный способ получения ацетилена
Номенклатура
Алкинами, ацетиленовыми углеводородами называют углеводороды, в состав молекул которых входят как минимум два углеродных атома, находящиеся в состоянии sp-гибридизации и соединенные друг с другом тремя связями.
Алкины образуют гомологический ряд с общей формулой СnН2n-2.
Первым членом гомологического ряда является ацетилен имеющий молекулярную формулу С2Н2 и структурную формулу СНºСН. В силу особенности sp-гибридизации молекула ацетилен имеет линейное строение. Наличие двух π-связей расположенных в двух взаимно перпендикулярных плоскостях предполагает расположение α-атомов замещающих групп на линии пересечения плоскостей, в которых расположены π-связи. Поэтому связи атомов углерода, затраченные на соединение с другими атомами или группами жестко расположены на линии под углом 1800 друг к другу. Строение системы тройной связи в молекулах алкинов определят их линейное строение.
Особенность строения молекул алкинов предполагает существование изомерии положения тройной связи. Структурная изомерия, обусловленная строением углеродного скелета, начинается с пятого члена гомологического ряда.
1. Изомерия положения тройной связи. Например:
2. Структурные изомеры. Например:
Первый член гомологического ряда носит тривиальное название «ацетилен».
По рациональной номенклатуре ацетиленовые углеводороды рассматриваются как производные ацетилена, Например:
По номенклатуре ИЮПАК названия алкинов образуются заменой суффикса «ан» на «ин». Главную цепь выбирают таким образом, чтобы в нее попала тройная связь. Нумерацию углеродных атомов начинают с того конца цепи, к которому ближе тройная связь. При наличии в молекуле двойной и тройной связей двойная связь имеет меньший номер. Например:
Тройная связь может быть концевой (терминальной, например, в пропине) или «внутренней», например в 4-метил-2-пентине.
При составлении названий радикал -СºСН называют «этинил».
Способы получения.
2.1 Промышленные способы.
В промышленных условиях получают главным образом ацетилен. Существуют два способа получения ацетилена.
Карбидный способ получения ацетилена
Ацетилен впервые карбидным способом был получен Фридрихом Велером в 1862г. Появление карбидного способа положило начало широкому применению ацетилена, в том числе и в качестве сырья в органическом синтезе. До настоячщего времени карбидный способ является одним из основных промышленных источников ацетилена. Способ включает две реакции:
Методы получения карбидов
Карбиды могут быть получены взаимодействием углерода и его соединений с металлами или их соединениями. Известны следующие способы получения карбидов: 1) получение карбидов в литом виде;
2) науглероживание порошков металлов (или окислов) твердым углеродом;
3) науглероживание порошков металлов (или окислов) газами, содержащими углерод (часто в присутствии твердого углерода);
4) осаждение из газовой фазы (метод наращивания);
5) химическое выделение карбидной фазы или углеродистых ферросплавов или расплавов (метод растворения);
6) электролиз расплавов соответствующих солей.
Промышленное применение имеют первые три способа.
Получение литых карбидов основано на сплавлении металлов с углеродом и возможно только в электрической или высокочастотной печи, так как температуры образования и плавления карбидов тугоплавких металлов лежат в пределах 2500—4000° С. Это вызывает определенные технические трудности, поэтому способ получения литых карбидов имеет ограниченное применение.
Получение карбидов науглероживанием порошков металлов или окислов металлов твердым углеродом имеет наибольшее распространение и используется для промышленного приготовления карбидов вольфрама, титана, молибдена, тантала, ванадия и других карбидов, применяемых в производстве твердых сплавов.
В качестве исходного сырья при этом способе используют порошки чистых металлов или их окислов. Углерод вводят в смесь в виде тонкого порошка сахарного угля или сажи. Смесь металла (или окисла) с углеродом тщательно перемешивают в шаровых мельницах всухую или мокрым способом. При смешивании металла с твердым углеродом дают от 5 до 10% избытка углерода (по сравнению с теоретическим содержанием его), так как в металлических порошках имеется остаточный кислород, а также для компенсации частичного выгорания углерода в печи.
При использовании смесей окислов металла с углеродом учитывают науглероживающее действие образующейся окиси углерода и применяемого защитного газа. Обычно для реакции достаточно 80—90%-ного количества углерода, которое соответствует уравнению
Науглероживание (карбидизацию) проводят в одну или несколько стадий в электрических или реже в газовых печах. Кроме муфельных печей непрерывного действия, применяют угольные трубчатые печи сопротивления, методические печи с молибденовыми нагревателями и вертикальные трехфазные криптоловые печи, а также высокочастотные печи периодического действия с графитовыми тиглями.
В качестве защитного газа используют водород, окись углерода, метан и смеси этих газов. При получении карбидов волфрама и молибдена в качестве защитного газа можно использовать генераторный газ или диссоциированный аммиак.
Реакция науглероживания при образовании монокарбидов протекает по следующим уравнениям:
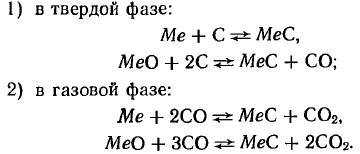
Карбиды молибдена, вольфрама и тантала лучше всего получать науглероживанием металлических порошков сажистым углеродом при температуре 1200—1600°С.
Вольфрам образует два стойких при комнатной температуре карбида: W2C и WC. При науглероживании в твердом состоянии образуется преимущественно монокарбид вольфрама WC, при науглероживании в расплаве образуется W2C. Металлокерамические твердые сплавы содержат исключительно монокарбид вольфрама.
Карбид титана готовят из смеси возможно более чистой двуокиси титана с газовой сажей при температуре 1700—2100° С.
Получение карбидов науглероживанием металловили окислов углеродсодержащими газами. Выше было показано, что при карбидизации в твердом состоянии науглероживание частично происходит и через газовую фазу. В связи с этим возможно получение карбидов науглероживанием исключительно через газовую фазу. Для этого обычно используют металл и углеводород, в результате реакции получают карбид металла и водород. Газовая карбидизация металлов происходит при более высокой температуре.
Науглероживание окислов углеродсодержащими газами проводится редко.
Химические свойства
Немаловажное значение имеют и химические свойства. Они также учитываются при применении материала. К основным характеристикам можно отнести следующие качества:
К основным характеристикам можно отнести следующие качества:
- Карбид кальция характеризуется тем, что хорошо впитывает влагу. Стоит учитывать, подобная процедура проявляется яркой химической реакцией, связанной с разложением вещества.
- При работе с рассматриваемым материалом стоит учитывать, что образующаяся пыль оказывает раздражительный эффект на слизистые органы. Кроме этого, подобная реакция может проявится при попадании кристаллов или пыли на поверхность кожи. Именно поэтому при работе с рассматриваемым соединением следует использовать респиратор и некоторые другие средства защиты.
- Кристаллы активное реагируют на воздействие других веществ зачастую только при нагреве. При этом может образоваться карбонат кальция.
- В некоторых случаях проводится соединение кристаллического вещества с азотом, в результате чего получается цианамид кальция.
- При нагреве может проходить реакция с мышьяком и хлором, а также фосфором.

Карбонат кальция
Считается, что наиболее важным химическим качеством является податливость к разложению при воздействии воды.
Сварка карбидом
Сварка карбида, сделанного на основе кремния, подразумевает его непосредственный контакт с водой, в ходе которого выделяется значительное количество ацетиленового газа и много тепла. Из-за данной эксплуатационной характеристики обеспечить безопасное хранение данного материала не так-то просто. Для того чтобы это сделать, карбид кладут в абсолютно герметичные баки, выполненные из кровельного металла. В них должно помещаться от 100 до 130 кг.
При сварке карбидом выделяется большое количество ацетилена — газа, отличающегося быстрой воспламеняемостью, поэтому при открытии таких бидонов следует позаботиться, чтобы поблизости не было искр и открытого пламени.
Сварочные работы с использованием карбидной пыли с размером частиц 2 мм и менее производиться не будут, так как такая пыль практически моментально растворяется в воде. Если же добавить в воду слишком большое количество такой пыли, то существует реальная вероятность взрыва. Между прочим, килограмм карбида может привести к выделению почти целого кубометра чистого ацетилена.
Карбид весьма широко используется для сварки газового типа, а также для резки металлов. Когда ацетилен начинает гореть вместе с кислородом, температура пламени может достигать свыше 3000 градусов по Цельсию. Это позволяет применять данный материал даже при работе с тугоплавкими материалами.
Какие меры безопасности нужны при работе с карбидом?
Выше говорилось, что карбид является взрывоопасным веществом, поэтому следует соблюдать определенные правила, которые помогут не допустить получения травм:
- Это вещество практически моментально вступает во взаимодействие с воздухом и водой, причем результатом данной химической реакции будет горючий ацетилен. Вследствие такого свойства карбида для сварки его следует хранить в абсолютно сухой и герметичной таре.
- Взрывоопасен не только выделяющийся газ, но и сам карбид, поэтому поблизости него не должно находиться искр или открытого пламени.
- Карбидная пыль с размером частиц менее 2 мм при попадании на кожу и глаза может вызвать раздражение, поэтому работать с материалом следует в защитных перчатках и в очках.
- Постоянная сварка с использованием карбида производится только в специальном помещении, где отсутствуют горючие вещества, а все предметы, находящиеся там, должны быть абсолютно несгораемыми. Хранить оборудование следует в полностью изолированных отсеках помещения. В нем должна быть оборудована система принудительной вентиляции.
- Генераторы ацетилена, использующие в своей работе карбид, категорически запрещено размещать в подвальных помещениях.
- Когда работы, связанные с проведением сварки, будут завершены, все загруженное вещество нужно будет выработать. Отработанные шлаки (они, как правило, представляют собой известковый налет) удаляются в бункер или в иное специально отведенное под это место.
- Нельзя курить поблизости от проведения работ, рядом с самим карбидом — использование открытого огня разрешено на расстоянии не менее 10 метров.
- Когда осуществляется транспортировка или хранение баллонов с ацетиленом, на клапаны в обязательном порядке надеваются защитные колпачки, также во время перевозки нельзя допускать соударения баллонов или тем более их падения. Производить транспортировку вместе с другими веществами также запрещено.
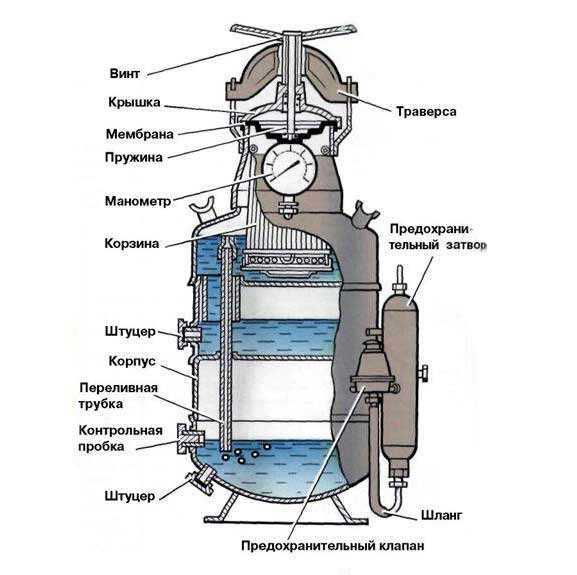
Как правильно применять карбид для проведения сварных работ?
Технология использования этого материала представляет собой следующую последовательность действий:
- Его куски укладывают в корзину, причем их величина не должна превышать 8 см в диаметре, так как такой размер позволяет обеспечить выделение наибольшего количества ацетилена. Всю карбидную пыль предварительно удаляют, чтобы не допустить детонации материала во время работ.
- В аппарат, заполненный водой, устанавливают эту корзину, тщательно закрывая ее специальной крышкой, оснащенной винтом поперечной подачи.
- Начинают аккуратно вращать маховик винта, чтобы корзина постепенно опустилась в воду. Резкого погружения не допускают, так как это может привести к воспламенению газа и последующему взрыву. Карбид начнет постепенно реагировать с водой, выделяя значительные объемы ацетилена.
С того момента, как началось выделение ацетилена, можно приступать к проведению сварочных работ. Используют карбид для сварки стали, нержавеющих материалов, цветных металлов, а также разного рода заготовок, отличающихся достаточно высокой температурой плавления. В разобранном виде установка для ацетиленовой сварки является абсолютно безопасной. electrod.biz
Что такое карбид?
Самодельные бомбы. Вот, что приходит на ум первым делом, когда слышим слово карбид. И нет, занимались производством этих опасных игрушек не предприятия оборонной промышленности, а, как правило, мальчишки, лет так десяти.
Лет двадцать назад это было излюбленное развлечение у подростков. Это сейчас все сидят за своими планшетами, а тогда миром правил пытливый ум ребенка, который норовил все испробовать на практике.
Для того, чтобы почувствовать себя Рембо, требовалось раздобыть один чудо-камешек. Находили их дети чаще всего на стройках. А дальше все было просто: пластиковый сосуд, камень, вода, плотно закрученный колпачок. Все это рьяно трясли, и в лучшем случае, отбрасывали куда подальше. А в худшем «снаряд» разрывало прямо в руках, тогда травм было не избежать.
Читать также: Как припаять светодиодную ленту в силиконе
Были и более безопасные пути использовать находку, к примеру, просто бросить в лужицу, тогда можно было наблюдать нечто похожее на действие современных бомбочек для ванны. Так что это за популярная «игрушка». Большинство из нас считали, что таким, как мы его знаем, карбид произвела природа. Но на самом деле это не так. И сегодня Вы в этом убедитесь.
Итак, вещество это всегда очень твердое, плюс ко всему, чтобы его расплавить, нужно приложить недюжинные усилия. На вид это темные, светлые, зеленоватые камни, либо порошок, все зависит от состава. Срок его годности недолог, как правило это полгода. Уложить емкости в общий склад не получится, у таких потенциально опасных веществ должен быть свой отсек.
Как Вы уже знаете, карбид постоянно норовит взорваться. Причем, некоторым соединениям даже особых условий не надо. Достаточно просто пересыпать порошок из тары в тару, как он может неожиданно рвануть.
Применение
Как уже упоминалось, чаще всего это вещество можно встретить на стройке. И там ему находят десятки способов применения. В шлифовке без этого материала трудно обойтись, из него производят спец. диски. Но хорош он не только в качестве абразива, но и в виде острых режущих кругов, ножей и тому подобного.
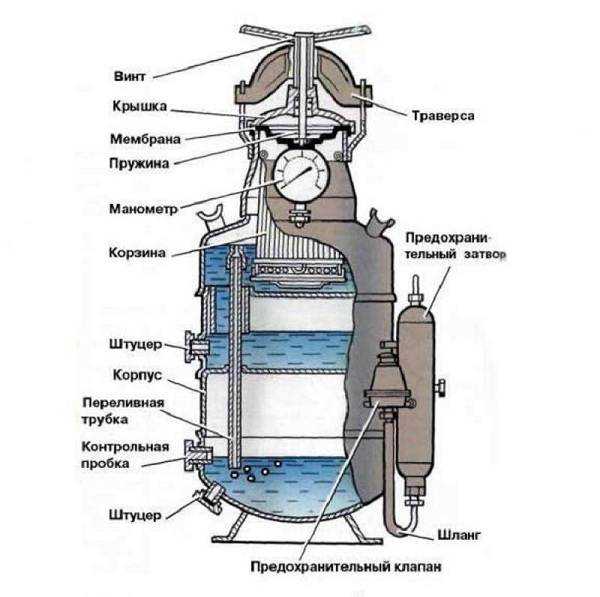
Генератор ацитиленовый для газосварки, внутрь которого засыпается карбид кальция
Машиностроение – еще одна возможность использовать это соединение. Из карбида получаются не только различные детали автомобилей, но и зап. части для радио приборов. А благодаря своей теплопроводности он отлично справится и с задачей нагревательного типа. Даже в ядерной промышленности без такого составляющего никак. Все это требует особой прочности, поэтому здесь речь чаще всего о ковалентных видах.
Те составы, что содержат карбид железа, позволяют получить сталь, и всем известный чугун. Кремниевые соединения так же ценят ювелиры и производители осветительных элементов. Искусственный каучук и смолы, и даже уксусная кислота – настолько широк круг применения карбидов.
Но этим дело не ограничивается. Этот искусственный минерал еще и для огородников важен. Ведь с его помощью получают особый вид удобрений. Они способны регулировать скорость роста различных культур.
Но, пожалуй, самый популярный из всех – карбид кальция. Ведь именно его в своей работе активно используют сварщики. Казалось бы, как этот темный камушек с чесночным ароматом может быть задействован в таком процессе?
Очень просто, ведь для газовой сварки, что логично, нужен горючий газ. В нашем случае дает карбид ацетилен. Как только он «встречается» с кислородом, мы получаем весьма интенсивное пламя, его температурные показатели переступают отметку в три тысячи градусов.
Если брать уже готовый летучий газ, то упаковкой ему служат спец. емкости, в них вещество доставляют к месту действия. Никакой тряски, или ударов во время такой поездки быть не должно – смертельно опасно.
Это сырье может вспыхнуть, даже без лишней «помощи», потому внимание всегда должно быть на пределе. Если же пожара избежать не удалось, никакой влаги при тушении
В ход должны идти только порошковые способы тушения.

Есть второй путь – произвести это «топливо» прямо на месте работ. Для этого нужно знать, что такое гидролиз карбидов. Говоря проще, это реакция соединения на контакт с водой. Причем, этот самую реакцию может вызвать даже одна капля.
Потому, если собрались осуществить сварочные работы, предельно аккуратно вскрываем герметичную тару с карбидом
Особо важно, чтобы никаких признаков огня по соседству, иначе ЧП гарантированно. О сигаретах и вовсе стоит забыть
Еще следите за тем, чтобы даже самые мелкие крошки не оказались на Вашей коже, тем более на слизистых, иначе, в лучшем случае – раздражение, с худшем- ожоги и распухшие части тела. Так что вооружайтесь спец. обмундирование: защитить нужно все, с ног до головы, в том числе и дыхательные пути. Первая помощь, если контакта избежать не удалось: обильно поливаем водой пораженный участок, покрываем его плотным кремом. При необходимости вызвать врача.
Если говорить о расходе, если масса карбида один килограмм, то это дает возможность выработать до трехсот кубических дециметров газа. Это достаточно хорошие показатели. Так же на такое количество сырья потребуется примерно литров 20 воды, хотя производители и заявляют, что достаточно будет полулитра. То, сколько времени все это займет, зависит от величины фракций соединения, и их чистоты.
После того, как с работой закончили, оставшиеся отходы, а это шлак из извести, не оставляем где попало, а утилизируем. Для таких работ потребуется спец. генератор. Бывают они внушительных размеров, их устанавливают на одном месте, к примеру, когда планируются масштабные работы. Но существует и мини-версия, переносная.
Сначала отсек, в котором и должен образоваться газ, заливаем водой, потом уже добавляем туда карбид. Идет реакция, появившийся в результате ацетилен по мягкой трубке поступает непосредственно к газовой горелке. Этот путь должен быть достаточно длинным, шланг обязательно нужно выбрать не короче десяти метров.
Карбид бора
Идет в дело и карбид бора. Предметы на его основе дают надежную защиту от огня. И не только от огня, кстати, ведь такой товар активно используют изготовители бронежилетов. Во-первых, он «ловит» пули, а во-вторых, не даст прохода и радиации. Что касается такого союза, как карбид алюминия, то сверкающие искры во время фейерверков – его заслуга. А ведь на вид это ничем не примечательный желтый порошок.
Химические свойства
Почти все карбиды взаимодействуют с водой. Какие-то — легко и без нагревания (например, карбид кальция), а какие-то (например, карбид кремния) — при нагревании водяного пара до 1800 градусов. Реакционная способность при этом зависит от характера связи в соединении, о котором мы поговорим позже. В реакции с водой образуются разные углеводороды. Происходит это потому, что водород, содержащийся в воде, соединяется с углеродом, находящимся в карбиде. Понять, какой углеводород получится (а может получиться как предельное, так и непредельное соединение), можно, исходя из валентности содержащегося в исходном веществе углерода. Например, если у нас есть карбид кальция, формула которого CaC2, мы видим, что он содержит ион C22-. Значит, к нему можно присоединить два иона водорода с зарядом +. Таким образом, получаем соединение C2H2 — ацетилен. Таким же образом из такого соединения, как карбид алюминия, формула которого Al4C3, получаем CH4. Почему не C3H12, спросите вы? Ведь ион имеет заряд 12-. Дело в том, что максимальное количество атомов водорода определяется формулой 2n+2, где n — количество атомов углерода. Значит, может существовать только соединение с формулой C3H8 (пропан), а тот ион с зарядом 12- распадается на три иона с зарядом 4-, которые и дают при соединении с протонами молекулы метана.
Интересными представляются реакции окисления карбидов. Они могут происходить как при воздействии сильных смесей окислителей, так и при обыкновенном горении в атмосфере кислорода. Если с кислородом всё понятно: получаются два окисда, то с другими окислителями интереснее. Всё зависит от природы металла, входящего в состав карбида, а также от природы окислителя. Например, карбид кремния, формула которого SiC, при взаимодействии со смесью азотной и плавиковой кислот образует гексафторкремниевую кислоту с выделением углекислого газа. А при проведении той же реакции, но с одной только азотной кислотой, получаем оксид кремния и углекислый газ. К окислителям также можно отнести галогены и халькогены. С ними взаимодействует любой карбид, формула реакции зависит только от его строения.
Карбиды металлов, формулы которых мы рассмотрели — далеко не единственные представители этого класса соединений
Сейчас мы подробнее рассмотрим каждое промышленно важное соединение этого класса и затем поговорим об их применении в нашей жизни

Свойства
Физические свойства
- Бесцветные тетрагональные кристаллы.
- Плотность: 228 (+20 °C, г/см3).
- Удельная теплоёмкость при постоянном давлении (в Дж/г·K): 0,92 (+20—325 °C).
- Стандартная энтальпия образования ΔfH (298 К, кДж/моль): −62,8 (т).
- Стандартная энергия Гиббса образования ΔfG (298 К, кДж/моль): −67,8 (т).
- Стандартная энтропия образования S (298 К, Дж/моль·K): 70,3 (т).
- Стандартная мольная теплоёмкость Cp (298 К, Дж/моль·K): 62,34 (т).
- Энтальпия плавления ΔHпл (кДж/моль): 32,2.
- Карбид кальция имеет резкий чесночный запах.
Химические свойства
При взаимодействии c водой карбид кальция гидролизуется с образованием ацетилена и гидроксида кальция (гашёной извести):
Представленная выше реакция является экзотермической.
Точка кипения
ЦК2 кипит при 2300ºC с разложением. Точку кипения необходимо измерять в инертной атмосфере, то есть без кислорода и влаги.
Физиологическое действие
- Среди всех неорганических производных кальция CaC2 очень ядовит.
- По степени воздействия на организм человека карбид кальция относится к 1-му классу опасности согласно ГОСТ 12.1.007.
- Попадание карбида кальция внутрь организма также является опасным.
- Пыль карбида кальция оказывает раздражающее действие на кожу, слизистые оболочки органов дыхания.
- Карбид кальция CaC2 чрезвычайно опасен для окружающей среды.
Внешний вид и характеристики технического карбида кальция
Впервые рассматриваемый состав был получен в 1862 году. Проводимая процедура касалась отделения кальция от извести, в результате чего получился бледно-серый состав без признаков, свойственных металлам. В результате опыта был получен карбид, который в последствии стал активно использоваться при выпуске различной продукции.
В начале 20 века карбид кальция стали использовать для производства ацетилена в больших объемах. Именно поэтому стали вести активные исследования для выявления более производительной технологии.
Технические характеристики материала определяют его широкое распространение. Внешний вид вещества характеризуется светло-серым цветом, выпускаются карбиды в виде камня или порошка.
Карбид кальция
Широкое распространение имеют два способа получения ацетилена:
- Разложением карбида кальция водой в специальных ацетиленовых генераторах. (см. статью «Карбид кальция и ацетилен друзья не разлей вода»)
- Из углеводородных продуктов, содержащихся в природных газах, нефти, газах от переработки угля и торфосланцев.
На данный момент способ получения ацетилена из карбида кальция используется редко, поскольку он довольно громоздкий, дорогой и требующий затрат большого количества электроэнергии.
Поэтому на смену ему пришел способ производства ацетилена из природного газа (метана) термоокислительным пиролизом метана с кислородом (так называемый пиролизный ацетилен).
Ацетилен химическое соединение углерода и водорода. Ацетилен легче воздуха, 1 м3 ацетилена при 20°С и 760 мм рт. ст. плотность ацетилена равна 1,091 кг/м3. Плотность по отношению к воздуху 0,9. Критическая температура 35,9°С и критическое давление 61,6 кгс/см2. При сгорании с кислородом он дает пламя с наиболее высокой температурой, которая достигает 3200°С, что объясняется его эндотермичностью (другие углеводороды экзотермичны, т. е. при распаде поглощают тепло). Химическая формула — C2h3, структурная формула Н-С=С-Н.
Ацетилен полимеризуется при температуре 400-800°C.
Полимеризации ацетилена соединение нескольких молекул в одну с образованием других более сложных соединений: бензола (CH), стирола (CH), нафталина (CH), толуола (CH) и другие, жидкие смолообразные продукты сложного состава.
Молекулы соединений, образующихся в результате полимеризации, содержат меньше потенциальной энергии, чем молекулы ацетилена, так как их образование происходит с выделением тепла, благодаря чему они более устойчивы.
Ацетиленовый генератор аппарат, служащий для получения ацетилена разложением карбида кальция водой.
Ацетиленовые генераторы, применяемые для сварки и резки металлов согласно ГОСТ 5190-78, классифицируются по следующим признакам:
Этот переносной ацетиленовый генератор производительностью 1,25 м3/ч, рабочим давлением 0,01-0,07 МПа работает по системе ВВ. (см. Ацетиленовый генератор). Генератор представляет собой вертикальный цилиндрический сосуд. Корпус 5 генератора состоит из трех частей:
- верхней (газообразователь);
- средней (вытеснитель)
- нижней (промыватель).
Воду заливают в газообразователь через горловину.
Ацетиленовый генератор АН В-1,25. Этот переносной генератор низкого давления работает по системе ВВ в сочетании с системой ВК (см. статью Ацетиленовый генератор). Генератор является одноретортным, однопостовым генератором прерывистого действия, может быть использован на монтажных и ремонтных работах в зимних условиях при температуре до -25°С (248 К).
weldering.com

































